- Есть вопросы?
- 8(961)1155384
- zakaz@kursach37.com
Примеры решения задач по Химии

| 1.Какую низшую и высшую степени окисления проявляет углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение Высшую степень окисления определяют по номеру группы. Углерод +4 СО2 –оксид углерода (1V) |
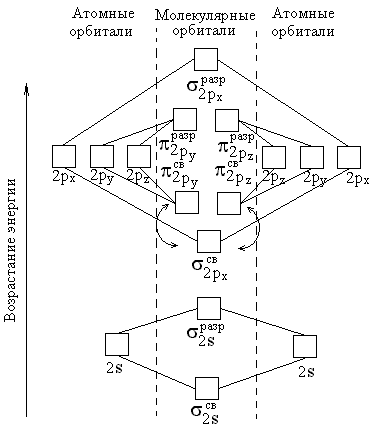
| 2.Нарисуйте энергетическую схему образования О2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
Решение В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (св) и разрыхляющими (разр) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности: |
| 3.Вычислите тепловой эффект реакции восстановления одного моля Fe2O3 металлическим алюминием. Ответ: -847,7 кДж.
Решение n(Fe2O3)=1 моль, Fe2O3+2Al DHo298=DHo298(Al2O3)+2DHo298(Fe)-DHo298(Fe2O3)-2DHo298(Al)= — 1675,69+822,16= -847,7 кДж; Q=-DHo298*n=853,53 кДж/моль * 1 моль= 847,7 кДж. Ответ: Q = 847,7 кДж; DHo298= -847,7 кДж. |
| 4.При какой температуре наступит равновесие системы: 4HCl(г) + O2(г) Решение ?H – ?U = ? n RT |
| 5.Реакция идет по уравнению СО(г) + Н2О(г) Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ССО= 3моль/л, Сн2о= 2моль/л. Ответ: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] =3 – 1,2 =1,8 моль/л; [H2O] =2 – 1,2 = 0,8 моль/л. Решение При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
В условии задачи даны исходные концентрации, тогда как в выражение Кс входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2]=х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ: |

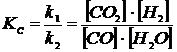 .
.