- Есть вопросы?
- 8(961)1155384
- zakaz@kursach37.com
Примеры решения задач по Химии

| 1. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению CH4(г) + СO2(г) = 2СО(г) + 2Н2(г); ?Н = +247,37 кДж. При какой температуре начнется эта реакция? Решение CH4(г) + СO2(г) = 2СО(г) + 2Н2(г); Н = +247,37 кДж. |
| 2.Реакция горения метилового спирта выражается термохимическим уравнением: CH3OH(ж) + 1?O2(г) = CO2(г) + 2H2O(ж); ?H = ? Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования CH3OH(ж) равна + 37,4 кДж. Решение ?H(СН3ОН(ж.)) = -238,7 кДж/моль |
| 3. Выразить в молях: а) 6,02•1022 молекул С2Н2; б) 1,8•1024 атомов азота; в) 3,01•1023 молекул NН3. Какова мольная масса указанных веществ. Решение Моль — это такое количество вещества (или его порция), которое содержит 6,02 • 1023 (округленно 6 · 1023 частиц (молекул, атомов или других частиц). |
| 4.При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного н.у. Вычислите эквивалент и атомный вес металла.
Эквивалентные массы вычисляются по закону эквивалентов, который математически может быть выражен зависимостью:
где Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах. Поэтому целесообразно воспользоваться следующей зависимостью:
В результате получаем:
Аг = 9·3 = 27. |
| 5.Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n = 4, l = 0, me = 0, ms = ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит.
Решение Квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,…, n-1). Каждому значению lсоответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, Магнитное квантовое число mопределяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число mпринимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО:  рx, рy, рz. Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы: ^ и v. 30Zn 1s2 2s2 2p6 3s2 3p6 3d10 4s2 Данный атом свободных 3d-орбиталей не содержит |

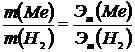 ,
,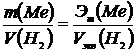 .
.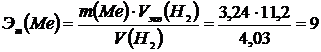 г/экв.
г/экв.

