| 1.Вычислите нормальную и молельную концентрации 20,8%-го раствора HNO3, плотность которого 1,12 г/см3. Сколько граммов кислоты сдержится в 4 л этого раствора?
Решение
Молярная концентрация, или молярность, показывает число молей (?) растворенного вещества, содержащих в 1 л раствора:
С = п / V р-ра
Массовая доля растворенного (А)) показывает число грамм (единиц массы) вещества, содержащееся вwвещества А ( 100 г (единиц массы) раствора.
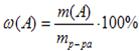
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как 0,1 н.
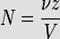 , ,
где:
- ? — количество растворённого вещества, моль;
- V — общий объём раствора, л;
- z — фактор эквивалентности.
Определим массу 10 % раствора азотной кислоты
m1(р-ра) = V1*d1 = 1,12х 4000 = 4480 г
m в-ва = m1(р-ра) w / 100 = 4480 х 20,8 / 100 = 931,81г
М (HNO3) = 1+ 14+48= 63
n = m / M = 931,81г/ 63 = 14.79 моль
С = 14.79/ 4000 = 0,0036 моль /л
N = 14.79 моль / 1000 = 0,02н р-р |
| 2.Вычислите процентную концентрацию водного раствора глицерина C3H5(OH)3, зная, что этот раствор кипит при 100,39 оС. Эбулиоскопическая константа воды 0,52 градуса.
Решение
0,39 = Kg
где g — моляльность.
g = 0,75 моль/кг. Т.е. 69 г/кг.
Доля: 69/(69 + 1000) = 0,0645 = 6,45%. |
3.Составьте ионно-молекулярные и молекулярные уравнения реакций взаимодействия в растворах между:
а) CuSO4 и H2S;
б) BaCO3 и HNO3;
в) FеCl3 и KOH.
Решение
а) CuSO4 + H2S > CuSv + H2SO4
Cu2+ + SO42– + 2H+ + S2– > CuSv + 2H+ + SO42–
Cu2+ + S2– > CuSv
б) BaCO3 + 2HNO3 > Ba(NO3)2 + H2CO3
Ba2+ + CO32– + 2H+ + 2NO3– > Ba2+ + 2NO3– + H2O + CO2
CO32– + 2H+ > H2O + CO2
в) FеCl3 + 3KOH > Fe(OH)3v + 3KCl
Fе3+ + 3Cl– + 3K+ + 3OH– > Fe(OH)3v + 3K+ + 3Cl–
Fе3+ + 3OH– > Fe(OH)3v |
4.Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3.
Какое значение pH(>7<) имеют растворы этих солей?
Решение:
|
Pb(NO3)2
|
 Pb(OH)2 – слабое основание Pb(OH)2 – слабое основание |
 HNO3 – сильная кислота HNO3 – сильная кислота |
Pb(NO3)2 + 2HOH > Pb(OH)2v +2HNO3
Pb2+ + 2NO3– + 2HOH > Pb(OH)2v +2H+ +2NO3–
Pb2+ + 2HOH > Pb(OH)2v +2H+
pH > 7 – кислая.
|
Na2CO3
|
 NaOH – сильное основание NaOH – сильное основание |
 H2CO3 – слабая кислота H2CO3 – слабая кислота |
Na2CO3 + 2HOH > 2NaOH + H2O + CO2
2Na+ + CO32– + 2HOH > 2Na+ + 2OH– + HOH +CO2
CO32– + 2HOH > 2OH– + HOH +CO2
CO32– + HOH > 2OH– +CO2
pH < 7 – щелочная.
|
Fe2(SO4)3
|
 Fe(OH)3 – слабое основание Fe(OH)3 – слабое основание |
 H2SO4 – сильная кислота H2SO4 – сильная кислота |
Fe2(SO4)3 + 6HOH > 2Fe(OH)3v +3H2SO4
2Fe3+ + 3SO42– + 6HOH > 2Fe(OH)3v +6H+ +3SO42–
2Fe3+ + 6HOH > 2Fe(OH)3v +6H+
Fe3+ + 3HOH > Fe(OH)3v +3H+
pH > 7 – кислая. |
5.Чем отличается структура кристалла хлорида натрия от структуры кристалла натрия? Какой вид связи осуществляется в этих кристаллах? Какие кристаллические решетки имеют натрий и хлорид натрия? Чему
равно координационное число натрия в этих решетках?
Решение
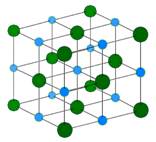 Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая. Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая.
Кристалл натрия разделяется на атомы натрия: Na(к) = Na(г);
Для веществ с металлической связью образуется металлическая кристаллическая решетка (в узлах КР находятся атом-ионы натрия, а между ними располагаются делокализованные общие электроны, принадлежащие сразу всем атом-ионам — электронный газ). В случае металлического натрия кристаллическая решетка кубическая гранецентрированная.
Вещества с ионной химической связью обладают ионной кристаллической решеткой (в узлах находятся ионы Na+ и Cl-, при этом они чередуются между собой через один). Тип кристаллической решетки в этом случае кубическая.
Таким образом один атом натрия в обоих случаях координирует 8 соседних частиц. Значит, координационное число натрия равно 8.
|
6.У какого элемента четвёртого периода – хрома или селена – сильнее
выражены металлические свойства? Какой из этих элементов образует
газообразное соединение с водородом? Ответ мотивируйте строением
атомов хрома и селена.
Решение
Каждый период начинается элементом, атомы которого образуют вещество – металл, а заканчиваются элементом, атомы которого образуют вещество – благородный газ. В периоде при движении слева направо металлические свойства убывают, неметаллические – возрастают.
Электронная конфигурация хрома 1s22s22p63s23p64s13d5, на внешнем энергетическом уровне 4s1 , а элементы у которых от 1 до 3 электронов на внешнем уровне — металлы, более 3х проявляют неметаллические свойства.
Водородные соединения – гидроксиды хрома(2 и 3) – Cr(OH)2; Cr(OH)3
Конфигурация внешней электронной оболочки атома Se 4s24p4; у двух p-электронов спины спарены, а у остальных двух — не спарены, поэтому атомы Селена способны образовывать молекулы Se2 или цепочки атомов Sen
Водород взаимодействует с Селеном при t>=200 °С, образуя H2Se; раствор H2Se в воде называется селеноводородной кислотой. |


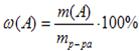
 Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая.
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия. Вид связи в кристалле хлорида натрия – ионная, в кристалле натрия – металлическая.